Recherches en cours au LEEA
Pour répondre aux besoins futurs en matière de stockage de l'électricité renouvelable et intermittente, il faudra des matériaux largement abondants, bon marché et renouvelables. En d'autres termes, de nouveaux composés actifs basés sur des éléments abondants sur Terre (C, H, O, N et S) qui peuvent être utilisés dans des électrolytes aqueux sont nécessaires pour le développement du stockage durable de l'énergie. Nos recherches portent sur le développement de piles rédox à flux et de batteries utilisant de nouvelles molécules organiques.
Les piles rédox à flux (RFB) reposent sur les mêmes principes fondamentaux que tous les autres types de piles : elles utilisent des réactions chimiques pour stocker et libérer de l'électricité. Les batteries conventionnelles stockent la charge dans des matériaux électroactifs en phase solide qui se trouvent dans les électrodes positives et négatives de la cellule. Les RFB utilisent des molécules électroactives en solution, formant deux électrolytes, un pour chaque côté de la batterie. Les solutions électrolytiques circulent en continu dans une cellule électrochimique, généralement composée de deux électrodes en carbone séparées par une membrane sélective des ions.
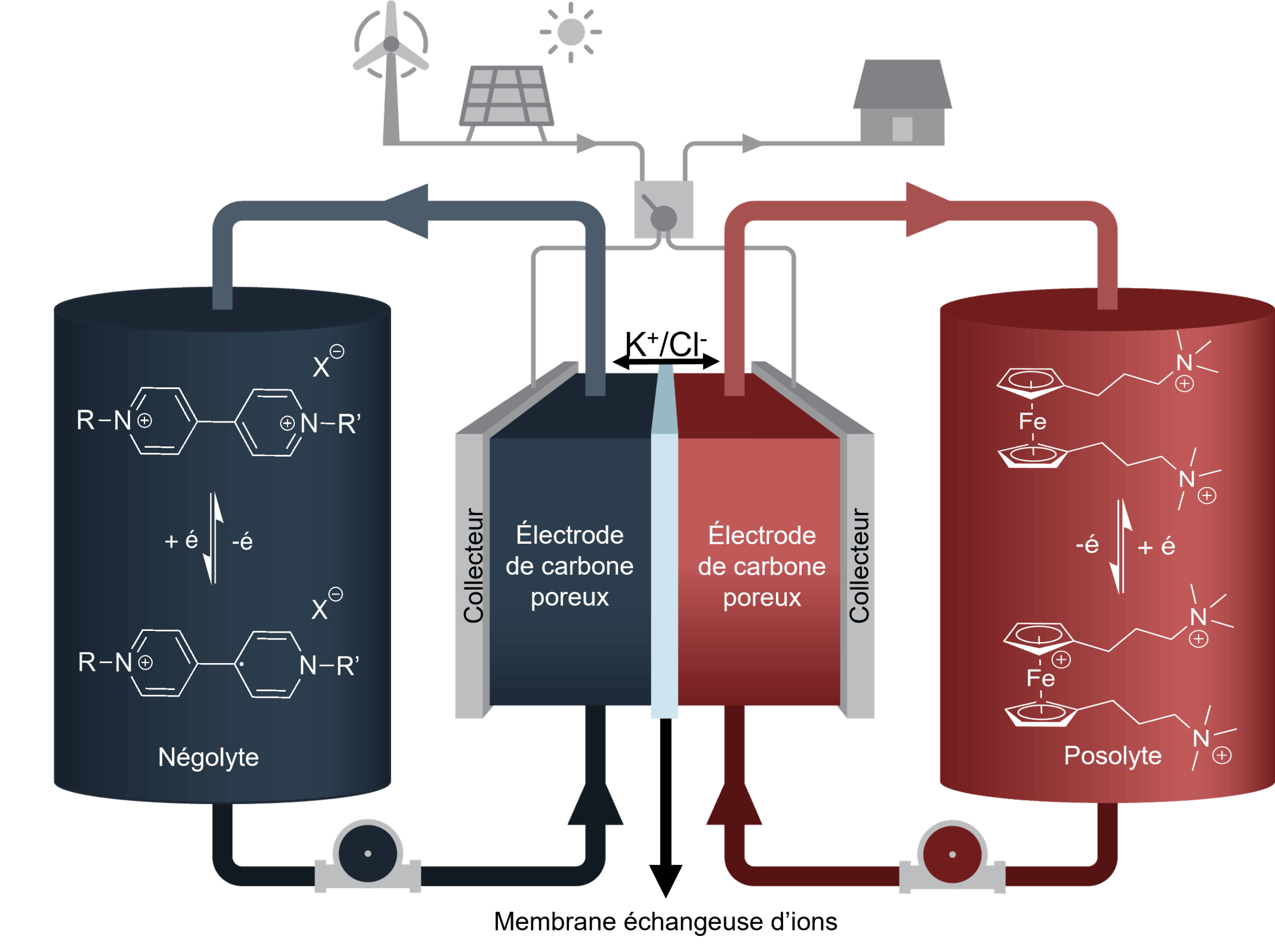
Nos recherches sur les RFB consistent à modifier les viologènes pour les rendre très solubles dans l'eau sur une large plage de pH, quel que soit leur état d'oxydation, tout en conservant, voire en améliorant, leurs propriétés électrochimiques. Via une collaboration étroite avec la Pre Hélène Lebel et le Pr Radu Iftimie, nous travaux vont du design jusqu'à l'analyse de nouvelles molécules en prototypes de piles.
Nos travaux sur les batteries organiques se concentrent sur les dérivés de la diphénoquinone, dont le potentiel redox est beaucoup plus élevé que celui des benzoquinones. Les diphénoquinones (DPQ) sont facilement accessibles et identifiées comme étant potentiellement biosourcées. En collaboration avec le groupe du Pr Jim Wuest, nous avons démontré la capacité des DPQ à l'état solide à maintenir une activité redox au cours de multiples cycles de charge/décharge en contact avec des électrolytes aqueux. Les DPQ substituées avec des groupement halogénés ont montré des propriétés particulièrement prometteuses pour le stockage de l'énergie dans des électrolytes aqueux acides avec un potentiel de réduction élevé de 0,92 V (vs ENH) et une rétention de 90 % de la charge initiale après 1 000 cycles. Les mécanismes impliqué lors du stockage avec ces molécules sont à l'étude en utilisant la DRX opérando. Nous développons aussi de nouveaux électrolytes solide à base de cristaux ioniques de structure liquide ioniques contenant de hautes concentrations en sels de lithium (Organic ionic plastic crystals), dans le but de prévenir la dissolution des molécules actives et d'améliorer la durée de vie des batteries.
Nos recherches sur les supercapacités portent sur les systèmes à électrolytes rédox actifs et les pseudocapacités à base d'oxydes métalliques.
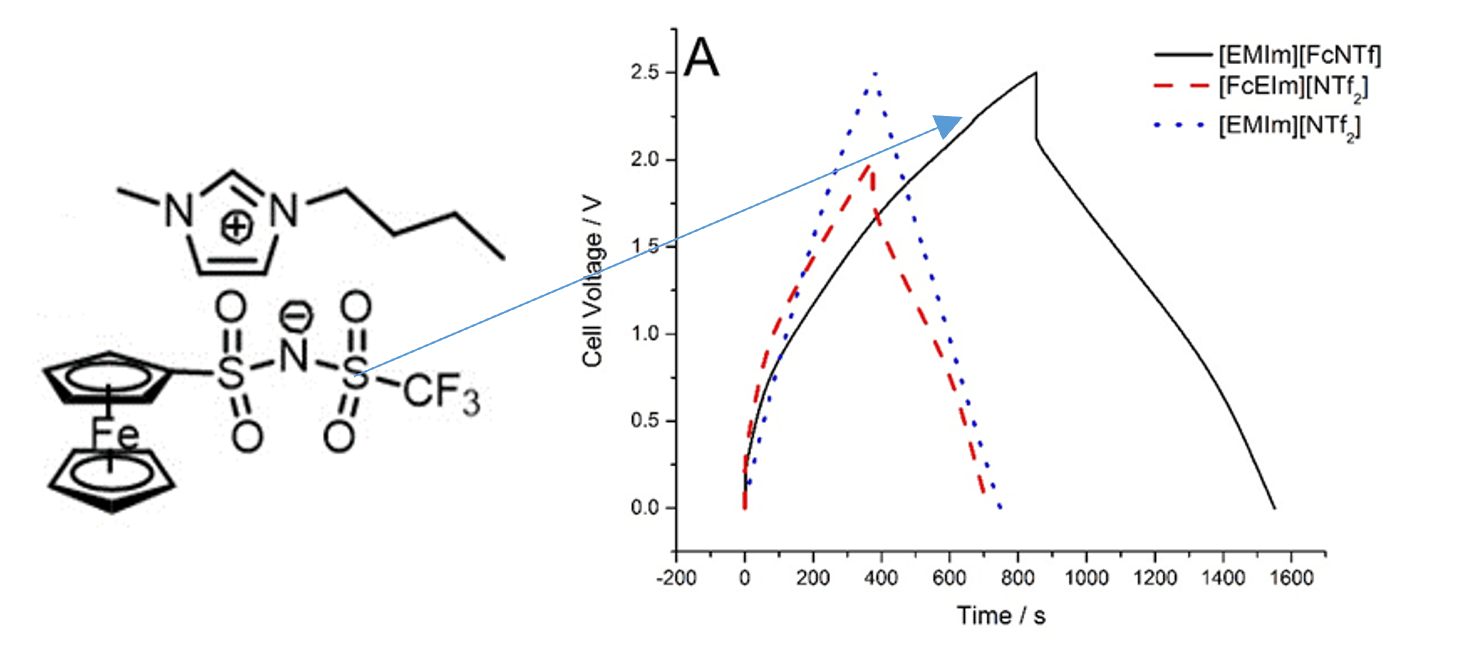
Le groupe développe des électrolytes rédox basés sur des liquides ioniques électrochimiquement actifs afin de stocker l'énergie dans la phase liquide. Cette approche vise à augmenter la densité d'énergie par de grandes concentrations de sites actifs en liquide se rapprochant de celles des solides, tout en prenant avantage du transport plus rapide des ions et sites actifs dans les phases liquides.
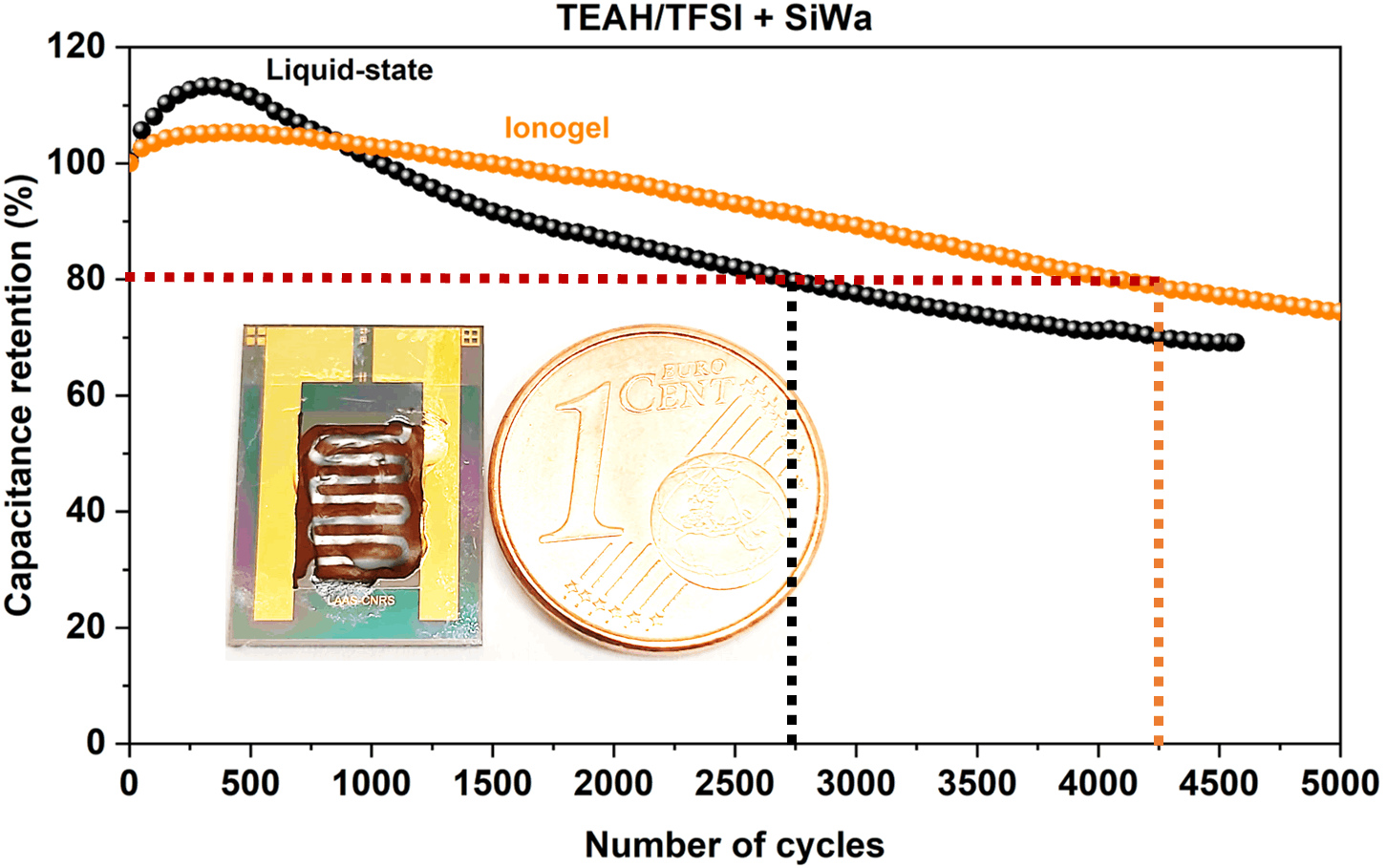
Au niveau des pseudocapacités, nos travaux visent à développer des électrolytes non-aqueux comme les liquides ioniques protiques, permettant le transport et l'échange de protons avec des électrodes à base de RuO2. L'absence de phase aqueuse résulte en une augmentation de la fenêtre de potentiel pour améliorer la densité d'énergie et prévient l'évaporation de l'électrolyte. Cette approche, développée dans le groupe, est appliquée aux microsupercapacités.
Nos recherches en électrochimie s'intéressent particulièrement aux milieux non-traditionnels. Toute réaction électrochimique est nécessairement influencée par le milieu électrolytique dans lequel elle s'effectue, notamment par la sphère de solvatation et le transport des espèces électroactives. Les modèles théoriques utilisés pour décrire ces phénomènes ont été développés en solutions idéalement diluées, mais les électrolytes avancés basés sur des liquides ioniques électroactifs ou des solutions hautement concentrées nécessitent de redéfinir ces modèles.
Les électrolytes hautement concentrés (EHC) possèdent un ratio molaire sel:solvant près de l'unité. Cette situation résulte en une sphère de solvatation incomplète des ions causée par le nombre insuffisant de molécules de solvant. L'impact de cette organisation sur les transferts électroniques hétérogènes est à l'étude dans le groupe en étudiant l'électrochimie de couples rédox en EHC.
Les liquides ioniques sont des phases liquides (point de fusion sous 100°C) constituées uniquement d'ions. L'absence de solvant résulte en une très grande concentration d'ions qui interagissent fortement entre eux. La modification de ces ions (souvent organiques) par des groupements rédox génère des phases liquides dont l'électroactivité est liée à la structure même du liquide. Une des particularités des liquides ioniques rédox est l'auto-échange qui s'établi avec des taux de transfert électroniques plus rapides que les valeurs dictées par le transport classique en milieu dilué.
En complément aux approches électrochimiques classiques, le groupe s'appuie sur des méthodes de caractérisation telles que la spectroscopie Raman et IR, la RMN, la XPS et plusieurs techniques de caractérisation des propriétés physico-chimiques.
Le laboratoire s'intéresse également au développement de méthodes in-situ couplant divers outils de caractérisation (XPS, SEM, QCM, AFM, GC-MS, ...) à des cellules électrochimiques afin d'étudier les réactions aux électrodes durant leur fonctionnement. Ces outils sont présentement en cours de développement grâce à une importante subvention de la Fondation Canadienne pour l'Innovation obtenue au département. Pour plus de détails, consulter le site du Montreal Area PLatform for Electrochemical Systems (MAPLES).